La médecine personnalisée : une opportunité d’améliorer la prise en charge des patients
La médecine personnalisée offre la possibilité d’utiliser des outils technologiques qui déterminent si les patients sont susceptibles de bénéficier de traitements spécifiques. L’accès à la médecine personnalisée représente ainsi un enjeu majeur pour améliorer les stratégies thérapeutiques. Le Swiss Personalized Health Network est la plateforme suisse pour développer les infrastructures permettant de faciliter l’échange de données de santé pour la recherche sur cette question ( OFSP, 2017 )¹. Toutefois, les efforts en la matière en France offrent déjà des données issues de la pratique. En effet, depuis une vingtaine d’années, la France a entrepris de prendre en charge les tests génétiques pour les médecins qui en font la demande auprès d’une des plateformes publiques de test. Ainsi, en 2006, l’Institut National du Cancer a financé 28 centres régionaux de génétique destinés à faciliter l’accès au profilage moléculaire des patients atteints de cancer. Ce contexte offre une opportunité unique pour mesurer l’égalité d’accès à la médecine personnalisée et les principaux déterminants au niveau départemental.
Analyses de données spatiales sur une population de plus de 15,000 patients
Entre avril 2012 et avril 2013, un projet national a collecté des données sur 15,814 patients diagnostiqués avec un cancer avancé du poumon non-à-petites cellules ( CPNPC ), et orientés par leur médecin pour un test génétique. Hypothétiquement, tous les patients atteints du CPNPC avancé auraient dû être identifiés car le profilage génétique est recommandé lors des soins courants. Pour déterminer l’égalité d’accès, nous avons donc utilisé une démarche de recherche en deux étapes : dans un premier temps, nous avons déterminé les taux d’accès ajustés aux besoins en soins par département de résidence du patient grâce à la méthode dite des “Small Areas Variations”. Dans
un second temps, nous avons réalisé un modèle de régression au niveau des départements pour déterminer la relation entre les taux ajustés et les variables économiques et d’offre de soins.
Une inégalité d’accès aux tests génétiques qui varie en fonction du département de résidence
Le taux de test génétique au niveau national est de 47 %, ce qui correspond à ce qui était attendu. Cependant, les taux varient significativement par département comme le montre la Figure 1 ( partie gauche ). Le plus faible “testeur” a un recours aux tests trois fois plus faible que le plus gros.
Figure 1. Gauche : Quintiles départementaux des taux d’accès ajustés de tests génétiques pour les CPNP en France parmi les habitants âgés de 20 à 99 ans. Droite : Indicateurs Locaux d’Association Spatiale (LISA) bivariés entre le taux de pauvreté et les taux de tests génétiques.
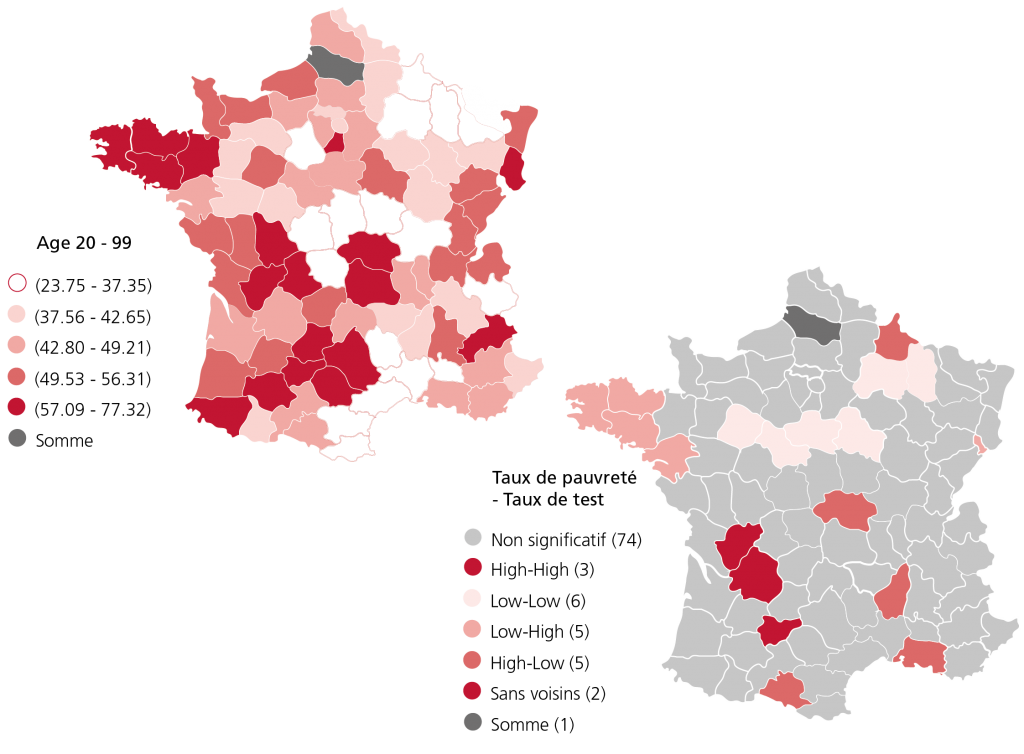
Par ailleurs, les résultats suggèrent qu’il existe une relation statistiquement significative entre les taux de dépistage génétique et l’offre par habitant de médecins généralistes, de radiothérapeutes ( corrélation positive ) et de chirurgiens ( corrélation négative ), pouvant suggérer des choix thérapeutiques différents effectués par ces professionnels. De même, en moyenne, des taux de dépistage génétique plus faibles sont associés à des taux de pauvreté plus élevés. Nous documentons la relation entre taux de pauvreté et taux de dépistage à l’aide d’Indicateurs Locaux d’Association Spatiale, une mesure de corrélation entre deux variables spatiales ( à droite sur la Figure 1 ). On identifie 4 combinaisons de relations particulièrement pertinentes, en fonction du niveau de pauvreté ( High ou Low ) et du taux de dépistage ( High ou Low ). Ainsi, 5 départements combinent des faibles taux de pauvreté avec des taux de test relativement élevés ( Low-High ), tandis que 5 autres départements combinent taux de pauvreté élevés et taux de dépistage faibles ( High-Low ). En revanche, 6 départements combinent un faible taux de pauvreté avec un faible niveau de tests ( Low-Low ), et enfin, 3 départements ont des taux de pauvreté élevés mais des taux de dépistage élevés ( High-High ). Les décideurs publics français devraient donc poursuivre leurs efforts en direction des zones ( dé )favorisées ( en particulier les 11 départements qui ont des taux de tests faibles ) afin d’obtenir un accès égalitaire à la médecine personnalisée. Enfin, les recommandations de pratique médicale pourraient permettre d’améliorer l’accès dans les départements ayant une forte densité de chirurgiens.
1. Office Fédéral de la Santé Publique ( 2017 ), Évolutions dans le domaine de la médecine axée sur les données; enjeux et tâches pour l’OFSP : Rapport du groupe de travail “Médecine personnalisée” de l’OFSP.
Note: cet article a été publié dans le cadre de l’IDHEAP Policy brief.
Référence:
- Kembou Nzale S, Weeks WB, Ouafik L, Rouquette I, Beau-Faller M, Lemoine A, Bringuier PP, Le Coroller Soriano AG, Barlesi F, Ventelou B. Inequity in access to personalized medicine in France:
Evidences from analysis of geo variations in the access to molecular profiling among advanced
non-small-cell lung cancer patients: Results from the IFCT Biomarkers France Study. PLoS One.
2020 Jul 1;15( 7 ):e0234387. doi: 10.1371/journal.pone.0234387. PMID: 32609781; PMCID:
PMC7329126.
Source de l’image: Unsplash.com






